Effet satiétogène des protéines laitières
Parmi tous les nutriments présents dans les aliments, les protéines sont réputées pour avoir un effet sur la satiété. De nombreux travaux (in vitro, in vivo et cliniques) ont en effet montré que les protéines avaient la capacité à moduler les signaux de la satiété, et donc l’état de faim.
Les protéines laitières n’échappent pas à cette réputation favorable sur la satiété, et font même partie des protéines les plus explorées par la science. D’ailleurs, les épidémiologistes mettent souvent en avant l’effet satiétogène des protéines laitières, pour expliquer la corrélation entre forte consommation de produits laitiers et moindres risques de diabète de type 2/syndrome métabolique.
Protéines laitières et satiété : mécanismes d’action
Induction de satiété par les acides aminés
Plusieurs mécanismes sont suggérés par les études scientifiques pour expliquer l’effet satiétogène des protéines laitières. Le premier mécanisme provient des acides aminés eux-mêmes, et explique de manière générale pourquoi les protéines ont un effet satiétogène. D’abord, le cerveau est capable de détecter le niveau d’acides aminés circulant, et de générer selon ces niveaux des signaux de satiété 3. Dans la mesure où les acides aminés à chaîne branchée (BCAA) peuvent être utilisés comme carburant par le cerveau, ces acides aminés – très présents dans les protéines de lactosérum – induisent donc un signal de satiété. Ensuite, le tryptophane et la tyrosine servent à la production de plusieurs neurotransmetteurs (notamment la sérotonine et les catécholamines), impliqués dans le contrôle de la prise alimentaire 4.
Production de peptides bioactifs à partir des protéines de lait
Le second mécanisme, spécifique aux protéines laitières, vient de leur capacité à générer des peptides bioactifs à l’issue de leur digestion. C’est l’action combinée des enzymes digestives, mais aussi probablement du microbiote intestinal, qui est à l’origine de ces peptides. Au moins 26 peptides ont été identifiés au sein des protéines laitières 4. Les β-casomorphines, dérivées des caséines, influencent ainsi directement la motilité gastro-intestinale (la capacité de l’organisme à faire avancer les aliments le long de l’intestin), la sécrétion d’insuline et la prise alimentaire 9. L’α-lactorphine, dérivée quant à elle des protéines de lactosérum, possède des effets similaires 8.
Peptides bioactifs et sensation de satiété
Ces peptides bioactifs agissent sur la satiété par interaction avec les hormones de la satiété. Il est bien démontré que les peptides bioactifs dérivés de la caséine et des protéines de lactosérum stimulent la sécrétion de la cholécystokinine (CCK) 6,10, hormone connue pour son effet sur la prise alimentaire et la satiété 14.
Les peptides bioactifs stimulent la sécrétion de la cholécystokinine, hormone connue pour son effet sur la prise alimentaire et la satiété.
Les protéines de lait stimulent également la sécrétion du peptide tyrosine-tyrosine (PYY), hormone également impliquée dans la sensation de satiété ; en parallèle, les protéines de lait répriment la sécrétion de ghréline, hormone favorisant la prise alimentaire 1,11.
Interactions entre peptides bioactifs et incrétines
Les travaux de recherche ont également démontré l’action des peptides bioactifs sur la sécrétion d’incrétines, à savoir le glucagon-like-peptide-1 (GLP-1) et le glucagon inhibitory peptide (GIP). Ces deux hormones, sécrétées par l’intestin au moment du passage du bol alimentaire, accentuent la production d’insuline par le pancréas. De cette manière, l’organisme reçoit un signal de « fin de repas » plus important, induisant une meilleure sensation de satiété 11. En plus de stimuler la sécrétion de ces hormones, les peptides bioactifs pourraient également prolonger leur demi-vie en inhibant la dipeptidyl peptidase-4 (DPP4), responsable de la dégradation des incrétines. Le tripeptide Ile-Pro-Ala, issu des protéines de lactosérum, a ainsi été identifié comme inhibiteur de la DPP4 15.
Insistons sur le fait que c’est l’association unique des acides aminés en peptides bioactifs qui entraînent ces sécrétions d’hormones satiétogènes ; les mêmes acides aminés, indépendants les uns des autres, n’ont pas cet effet. Ainsi, des acides aminés à chaîne branchée (BCAA) n’ont pas le même effet sur la sécrétion de glucagon inhibitory peptide (GIP) qu’une boisson comportant des protéines de lactosérum ; ces dernières conduisent à une hausse de la sécrétion en GIP, alors que les BCAA isolés n’ont aucun impact 13.
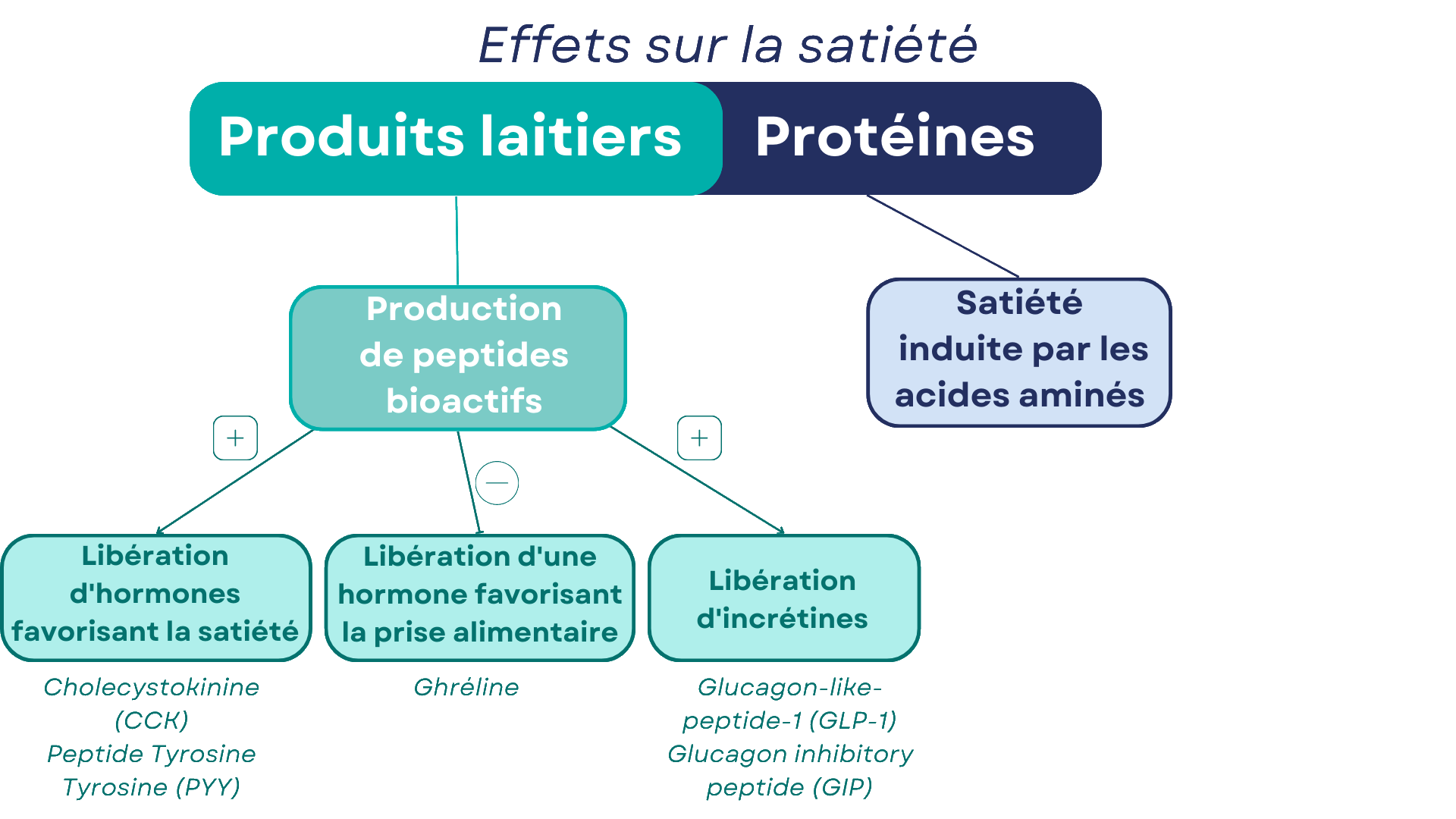
Fig : Les effets des protéines laitières sur la satiété
Caséines vs. Protéines de lactosérum : une question de temps
Par rapport aux effets satiétogènes, la différence entre caséines et protéines de lactosérum est temporelle. Les protéines de lactosérum agissent à court terme : une consommation de 45-50 g de protéines de lactosérum réduit ainsi la prise alimentaire lors d’un repas consommé entre 30 et 90 min après ingestion des protéines 2. Les caséines sont en revanche effectives pour des repas consommés environ 3h après leur ingestion 12. Ces résultats sont cohérents avec la différence de vitesse de digestibilité des deux types de protéines, et montrent surtout la complémentarité de ces deux types de protéines laitières.
Caséines et protéines de lactosérum sont tout aussi effectives pour agir sur la satiété ; elles ne le font cependant pas dans le même laps de temps.
Sur le plan mécanistique, les différences de temporalité ont pu également être confirmées avec la sécrétion de GLP-1, une des hormones clé de la satiété. Si une étude clinique a pu montrer que 3h post-repas, la sécrétion de GLP-1 était significativement plus élevée avec les protéines de lactosérum qu’avec la caséine 10, d’autres études ont en revanche montré que la sécrétion de GLP-1 se maintenait à plus long terme après la consommation de caséine 5,7. Ces résultats confirment que les caséines et protéines de lactosérum sont tout aussi effectives pour agir sur la satiété ; elles ne le font cependant pas dans le même laps de temps.
Conclusion
Les protéines laitières possèdent des fonctions physiologiques variées. En particulier, les protéines laitières possèdent des effets satiétogènes, qui s’expliquent par des mécanismes physiologiques bien documentés. La génération de peptides bioactifs, qui stimulent la sécrétion d’incrétines, sont des spécificités des protéines laitières qui expliquent leur effet sur la prise alimentaire. En définitive, les bénéfices constatés des produits laitiers sur le diabète de type 2/syndrome métabolique peuvent en partie être expliqués par ces effets physiologiques très particuliers des protéines laitières.
Les études scientifiques soulignent également la complémentarité des caséines et des protéines de lactosérum, qui ne sont pas à opposer : en effet, les deux types de protéines ont bien un effet satiétogène, mais avec un laps de temps différent. Cette différence peut donc être mise à profit pour créer différents produits visant à induire une satiété plus ou moins prolongée, selon les besoins du consommateur.
Sources :
[1] Akhavan, T., Panahi, S., Anderson, G. H., & Luhovyy, B. L. (2009). Application of dairy-derived ingredients in food intake and metabolic regulation. In Dairy-Derived Ingredients (pp. 212-237). Woodhead Publishing. https://doi.org/10.1533/9781845697198.2.212
[2] Anderson, G. H., & Moore, S. E. (2004). Dietary proteins in the regulation of food intake and body weight in humans. The Journal of nutrition, 134(4), 974S-979S. https://doi.org/10.1093/jn/134.4.974S
[3] Anderson, G. H., Luo, S., Trigazis, L., Kubis, G., & Li, E. T. (1994). Effects of essential amino acids on food and water intake of rats. Canadian journal of physiology and pharmacology, 72(8), 841-848. https://doi.org/10.1139/y94-119
[4] Anderson, H., Luhovyy, B., Akhavan, T., & Panahi, S. (2011). Milk proteins in the regulation of body weight, satiety, food intake and glycemia. Milk and milk products in human nutrition, 67, 147-159. https://doi.org/10.1159/000325581
[5] Boirie, Y., Dangin, M., Gachon, P., Vasson, M. P., Maubois, J. L., & Beaufrère, B. (1997). Slow and fast dietary proteins differently modulate postprandial protein accretion. Proceedings of the national academy of sciences, 94(26), 14930-14935. https://doi.org/10.1073/pnas.94.26.14930
[6] Bowen, J., Noakes, M., Trenerry, C., & Clifton, P. M. (2006). Energy intake, ghrelin, and cholecystokinin after different carbohydrate and protein preloads in overweight men. The Journal of Clinical Endocrinology & Metabolism, 91(4), 1477-1483. https://doi.org/10.1210/jc.2005-1856
[7] Calbet, J. A., & Holst, J. J. (2004). Gastric emptying, gastric secretion and enterogastrone response after administration of milk proteins or their peptide hydrolysates in humans. European journal of nutrition, 43(3), 127-139. https://doi.org/10.1007/s00394-004-0448-4
[8] FitzGerald, R. J., & Meisel, H. (2000). Milk protein-derived peptide inhibitors of angiotensin-I-converting enzyme. British journal of nutrition, 84(S1), 33-37. https://doi.org/10.1017/S0007114500002221
[9] Froetschel, M. A. (1996). Bioactive peptides in digesta that regulate gastrointestinal function and intake. Journal of animal science, 74(10), 2500-2522. https://doi.org/10.2527/1996.74102500x
[10] Hall, W. L., Millward, D. J., Long, S. J., & Morgan, L. M. (2003). Casein and whey exert different effects on plasma amino acid profiles, gastrointestinal hormone secretion and appetite. British Journal of Nutrition, 89(2), 239-248. https://doi.org/10.1079/BJN2002760
[11] Luhovyy, B. L., Akhavan, T., & Anderson, G. H. (2007). Whey proteins in the regulation of food intake and satiety. Journal of the American College of Nutrition, 26(6), 704S-712S. https://doi.org/10.1080/07315724.2007.10719651
[12] Moore, S. E. (2004). The effects of milk proteins on the regulation of short-term food intake and appetite in young men. https://tspace.library.utoronto.ca/handle/1807/118791
[13] Nilsson, M., Holst, J. J., & Björck, I. M. (2007). Metabolic effects of amino acid mixtures and whey protein in healthy subjects: studies using glucose-equivalent drinks. The American journal of clinical nutrition, 85(4), 996-1004. https://doi.org/10.1093/ajcn/85.4.996
[14] Strader, A. D., & Woods, S. C. (2005). Gastrointestinal hormones and food intake. Gastroenterology, 128(1), 175-191. https://doi.org/10.1053/j.gastro.2004.10.043
[15] Tulipano, G., Sibilia, V., Caroli, A. M., & Cocchi, D. (2011). Whey proteins as source of dipeptidyl dipeptidase IV (dipeptidyl peptidase-4) inhibitors. Peptides, 32(4), 835-838. https://doi.org/10.1016/j.peptides.2011.01.002