Quels rôles peuvent jouer les protéines sur le diabète de type II ?
Le diabète de type II (DT2) est une maladie caractérisée par une glycémie élevée appelée hyperglycémie. Les bases de la gestion du diabète se reposent sur une alimentation saine, l’activité physique et le traitement médicamenteux[1]. Cette gestion fait partie des plus difficile à mettre en œuvre[2]. En outre, de plus en plus de preuves de l’impact positif des protéines alimentaires, intégrées dans l’alimentation globale sont démontrées dans la gestion du DT2 et du pré-diabète[3].
Qu’est-ce que le diabète de type II ?
En général, le DT2 est caractérisé par une résistance à l’insuline, ce qui signifie que l’organisme (principalement les muscles et le foie – permettant de stocker le glucose sous forme de glycogène) n’est pas capable de répondre à l’insuline (jouant un rôle régulateur en maintenant la glycémie à des valeurs normales). En conséquence, le glucose sanguin est moins stocké, son taux continue d’augmenter et le pancréas sécrète d’avantage d’insuline. Jusqu’au moment où ce dernier ralentie sa production d’insuline, entraînant ainsi une augmentation plus importante de la glycémie (figure 1).
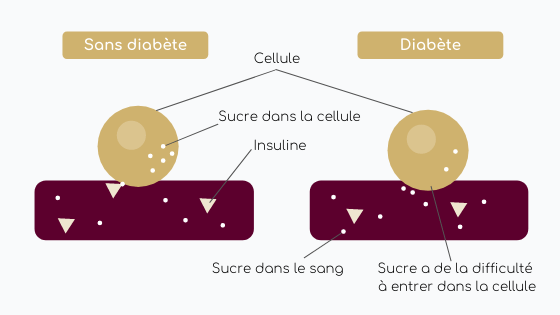
Figure 1 : Diagramme de la physiopathologie du diabète
Selon l’Organisation Mondiale de la Santé (OMS), une valeur de glycémie à jeun supérieure à 126 mg/dl accompagnée de signes et de symptômes constitue l’un des diagnostics du diabète[4]. Les personnes âgées sont les plus touchées par le DT2, même si nous observons de plus en plus d’enfants, d’adolescents et de jeunes adultes atteints de cette maladie(5). Cette prévalence accrue chez les jeunes pourrait être due à un niveau d’obésité plus élevé, à une activité physique moindre et à de mauvaises habitudes alimentaires[5].
Incidence et prévalence du diabète de type I et de type II – Différence par zones géographiques :
La Fédération Internationale du Diabète (FID) a prédit que le nombre d’adulte atteint de diabète (type 1 & 2) devrait passer de 425 millions en 2017 à 629 millions en 2045[5]. À l’échelle mondiale, la prévalence devrait passer de 8,3 % en 2019 à 9,6 % en 2045 (figure 2)[5].
De plus, des disparités existent entre les régions du monde. D’une part, la région du Moyen-Orient et de l’Afrique du Nord (MENA) présente chez les adultes, une prévalence du diabète, ajustée selon l’âge, la plus élevé. D’autre part, la région Afrique présente la plus faible prévalence ajustée selon l’âge (Figure 1)[6].
En ce qui concerne le nombre de cas, les pays qui comptent le plus grand nombre de diabétiques sont : la Chine, l’Inde et les États-Unis d’Amérique. Cette tendance devrait se poursuivre jusqu’en 2030[6].
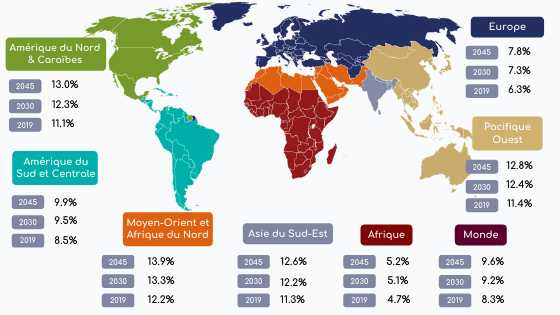
Figure 2 : Prévalence du diabète chez les adultes (20-79 ans) dans le monde (Adapté de FID.org[6])
A savoir, chez les personnes atteintes de diabète, le diabète de type II est le plus courant et représente 90% de cette population[6]. Pourquoi une telle augmentation du nombre de personnes atteintes du DT2 ? Cette hausse pourrait s’expliquer par les changements de régime alimentaire et la réduction de l’activité physique liés à l’urbanisation[5].
Risques et facteurs du diabète de type II
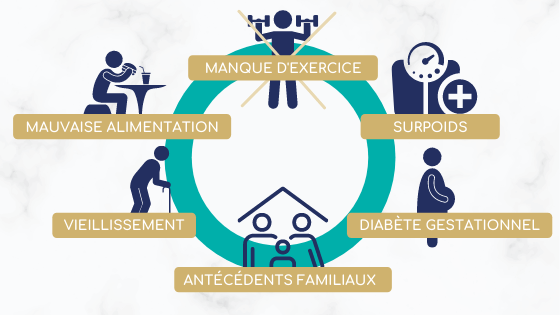
Figure 3 Exemples de facteurs de risque DT2 (Adapté de IDF.org5)
Symptômes du diabète de type II
Plusieurs symptômes sont rencontrés chez les patients DT2[5]. Ces derniers sont présentés dans la figure 4 :
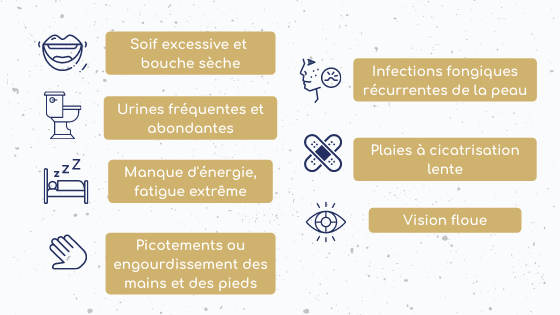
Figure 4 : Symptômes de DT2 (Adapté d’FID.org[5])
Impact socio-économique
La dépense mondiale est estimée à 760 milliards USD par la Fédération Internationale du Diabète[7]. Ce coût devrait augmenter et pourrait atteindre 825 milliards USD en 2030 et 845 milliards USD en 2045[7]. Les complications du diabète, comme les décès prématurés ou les handicaps, ont un impact économique et augmente de 35 % les dépenses annuelles liées à la santé[7].
Rôles des protéines du lait dans la gestion du diabète
Recommandations diététiques pour le diabète
La gestion du DT2 est soumise à des recommandations strictes comme un régime alimentaire sain, l’augmentation de l’activité physique et le maintien du poids. Pour aider à contrôler la glycémie, des médicaments et l’insuline sont fréquemment prescrits[5].
Nous savons que la résistance à l’insuline est une conséquence majeure de la progression du DT2. De plus, un poids élevé est un facteur prédominant dans le développement de la résistance à l’insuline[8]. En effet, des études ont démontré que la sensibilité à l’insuline et le contrôle du diabète sont améliorés avec une perte de poids de 7 à 10 % chez les patients atteints de DT2[9]. Par conséquent, la Fédération Internationale du Diabète recommande aux patients atteints de DT2 en surpoids et obèses de réduire leur apport calorique quotidien (-500 à 600 Kcal). Elle recommande également d’éviter le sucre, les sucreries, les boissons sucrées et de privilégier les aliments riches en fibres à faible indice glycémique[10].
Qu’en est-il des protéines ?
Les protéines jouent un rôle essentiel pour le corps humain. En effet, elles sont utilisées pour réparer, construire et renouveler les tissus de l’organisme comme la peau, les cheveux, les ongles, les muscles, etc. Contrairement aux idées reçues, les protéines n’induisent pas d’hyperglycémie[3]. Aujourd’hui, il n’y a pas de consensus international recommandant un apport en protéines pour optimiser la glycémie[1]. Néanmoins des fondations comme l’American Diabetes Association, proposent la recommandation suivante : Les patients diabétiques sans maladie rénale chronique devraient avoir un apport protéique supérieur à 1g/kg[11]. Par exemple, pour un patient diabétique de 70kg, le besoin protéique est de 70g.
Quelle est la meilleure source ?
La meilleure source de protéines pour la gestion diététique du diabète est encore à l’étude même si plusieurs études ont suggéré des différences sur les paramètres du DT2 selon les sources de protéines[12]. Une association inverse entre les apports en protéines laitières et le risque de DT2 a été démontrée par plusieurs études[13]. Aujourd’hui, ce mécanisme potentiellement protecteur des produits laitiers n’est pas entièrement compris. De plus, les essais contrôlés randomisés sont limités et ne permettent pas de recommander une certaine source de protéines[3].
Qu’en est-il des protéines de lactosérum ? Comment fonctionne-t-elle ? La “whey” pour réduire la glycémie
Un apport correct en protéines pourrait être bénéfique notamment pour leurs effets satiétogène et en aidant au maintien de la masse maigre[14] (comme les muscles) pendant la perte de poids. En ce qui concerne le contrôle de la glycémie, les protéines de lactosérum semblent avoir un impact sur la glycémie post-prandiale via les voies insuliniques[15]. En effet, il semble que la protéine de lactosérum, riche en acides aminés, améliore la sécrétion d’insuline[16,17]. Parmi ces acides aminés, la Leucine est intéressante car elle exerce des effets sur les cellules β pancréatiques, le foie, le muscle et le tissu adipeux et ainsi reconnue comme un influenceur de l’homéostasie du glucose[18]. Dans une étude clinique à court terme chez des patients atteints de DT2, la consommation de 50g de protéines de lactosérum avant un petit-déjeuner à indice glycémique élevé permet de diminuer la glycémie postprandiale[19].
En effet, il semble que la protéine de lactosérum, riche en acides aminés, améliore la sécrétion d’insuline.
Est-ce la seule explication ? Les protéines de Lactosérum pourraient avoir un impact sur le ralentissement de la vidange gastrique dans la population saine[20] et diabétique[21]. En effet, en la ralentissant, elle peut diminuer la libération post prandiale de glucose[22,23].
Concernant les effets à long terme de la supplémentation en lactosérum, le nombre d’études est très faible et des données limitées ont été publiées concernant son impact sur le contrôle glycémique. Par exemple, chez des patients DT2, une étude a montré que la consommation de 25g de protéines de lactosérum pendant 4 semaines avant le repas ralentissaient la vidange gastrique et réduisaient la glycémie postprandiale[24]. La même chose a été observée récemment avec 17g de protéine de lactosérum associée à du guar pendant 12 semaines[25].
Conclusion
En conclusion, un apport correct en protéines pourrait être bénéfique en préservant la masse maigre lors d’une perte de poids. Concernant les protéines de lactosérum, elles semblent avoir un impact sur la glycémie post prandiale via les voies insuliniques[15] ou en ralentissant la vidange gastrique et donc la libération du glucose[22,23].
Lactalis Ingredients propose Pronativ®, une protéine sérique native, particulièrement riche en leucine et, au regard des données bibliographiques, pourrait donc entrer dans la gestion diététique du diabète en contribuant à la normalisation de l’homéostasie du glucose.
Sources
1. Evert, A. B. et al. Nutrition therapy recommendations for the management of adults with diabetes. Diabetes Care 36, 3821–3842 (2013).
2. Yancy, W. S., Foy, M., Chalecki, A. M., Vernon, M. C. & Westman, E. C. A low-carbohydrate, ketogenic diet to treat type 2 diabetes. Nutr. Metab. 2, 34 (2005).
3. Campbell, A. P. & Rains, T. M. Dietary protein is important in the practical management of prediabetes and type 2 diabetes. J. Nutr. 145, 164S-169S (2015).
4. World Health Organization & International Diabetes Federation. Definition and diagnosis of diabetes mellitus and intermediate hyperglycaemia: report of a WHO/IDF consultation. (2006).
5. Type 2 diabetes. https://idf.org/aboutdiabetes/type-2-diabetes.html.
6. Demographic and geographic outline. https://diabetesatlas.org/en/sections/demographic-and-geographic-outline.html.
7. Individual, social and economic impact. https://diabetesatlas.org/en/sections/individual-social-and-economic-impact.html.
8. Chiasson, J.-L. & Rabasa-Lhoret, R. Prevention of type 2 diabetes: insulin resistance and beta-cell function. Diabetes 53 Suppl 3, S34-38 (2004).
9. Look AHEAD Research Group et al. Reduction in weight and cardiovascular disease risk factors in individuals with type 2 diabetes: one-year results of the look AHEAD trial. Diabetes Care 30, 1374–1383 (2007).
10. Guidelines. https://idf.org/e-library/guidelines/128-idf-clinical-practice-recommendations-for-managing-type-2-diabetes-in-primary-care.html.
11. Hamdy, O. & Horton, E. S. Protein Content in Diabetes Nutrition Plan. Curr. Diab. Rep. 11, 111–119 (2011).
12. Sluijs, I. et al. Dietary intake of total, animal, and vegetable protein and risk of type 2 diabetes in the European Prospective Investigation into Cancer and Nutrition (EPIC)-NL study. Diabetes Care 33, 43–48 (2010).
13. Hirahatake, K. M., Slavin, J. L., Maki, K. C. & Adams, S. H. Associations between dairy foods, diabetes, and metabolic health: potential mechanisms and future directions. Metabolism. 63, 618–627 (2014).
14. Martens, E. A. P. & Westerterp-Plantenga, M. S. Protein diets, body weight loss and weight maintenance. Curr. Opin. Clin. Nutr. Metab. Care 17, 75–79 (2014).
15. Akhavan, T. et al. Mechanism of action of pre-meal consumption of whey protein on glycemic control in young adults. J. Nutr. Biochem. 25, 36–43 (2014).
16. Floyd, J. C., Fajans, S. S., Conn, J. W., Knopf, R. F. & Rull, J. Stimulation of insulin secretion by amino acids. J. Clin. Invest. 45, 1487–1502 (1966).
17. Floyd, J. C. et al. Synergistic effect of essential amino acids and glucose upon insulin secretion in man. Diabetes 19, 109–115 (1970).
18. Yang, J., Chi, Y., Burkhardt, B. R., Guan, Y. & Wolf, B. A. Leucine metabolism in regulation of insulin secretion from pancreatic beta cells. Nutr. Rev. 68, 270–279 (2010).
19. Jakubowicz, D. et al. Incretin, insulinotropic and glucose-lowering effects of whey protein pre-load in type 2 diabetes: a randomised clinical trial. Diabetologia 57, 1807–1811 (2014).
20. Akhavan, T., Luhovyy, B. L., Brown, P. H., Cho, C. E. & Anderson, G. H. Effect of premeal consumption of whey protein and its hydrolysate on food intake and postmeal glycemia and insulin responses in young adults. Am. J. Clin. Nutr. 91, 966–975 (2010).
21. Ma, J. et al. Effects of a protein preload on gastric emptying, glycemia, and gut hormones after a carbohydrate meal in diet-controlled type 2 diabetes. Diabetes Care 32, 1600–1602 (2009).
22. Horowitz, M., Edelbroek, M. A., Wishart, J. M. & Straathof, J. W. Relationship between oral glucose tolerance and gastric emptying in normal healthy subjects. Diabetologia 36, 857–862 (1993).
23. Marathe, C. S., Rayner, C. K., Jones, K. L. & Horowitz, M. Relationships between gastric emptying, postprandial glycemia, and incretin hormones. Diabetes Care 36, 1396–1405 (2013).
24. Ma, J. et al. Sustained effects of a protein ‘preload’ on glycaemia and gastric emptying over 4 weeks in patients with type 2 diabetes: A randomized clinical trial. Diabetes Res. Clin. Pract. 108, e31-34 (2015).
25. Watson, L. E. et al. A whey/guar ‘preload’ improves postprandial glycaemia and glycated haemoglobin levels in type 2 diabetes: A 12-week, single-blind, randomized, placebo-controlled trial. Diabetes Obes. Metab. 21, 930–938 (2019).